Wie verursachen Entzündung, Sauerstoffmangel, Störungen des Säure-Basen- und Mineralstoff-Haushalts sowie Vitamin-D- und K-Mangel schwere Krankheitsverläufe?
COVID-19 ist eine Multiorgan-Erkrankung. Das bedeutet, dass fast alle Organe betroffen sein können. Wichtige Erkenntnisse hierzu liefern Autopsien von COVID-19-Verstorbenen. Neben der Lunge sind die Viren häufig auch in Nieren, Gehirn, Leber, Herz und Rachen zu finden.[1]Puelles VG, Lütgehetmann M, Lindenmeyer MT, Sperhake JP et al. (2020): Multiorgan and Renal Tropism of SARS-CoV-2. N Engl J Med 383; 6.
Das Herz-Kreislauf-System scheint von COVID-19 besonders betroffen zu sein. Auf der einen Seite gehen bestehende Herz-Kreislauf-Erkrankungen mit einem erhöhten Sterblichkeitsrisiko durch COVID-19 einher. Auf der anderen Seite scheint COVID-19 die Entwicklung von Herz-Kreislauf-Störungen zu fördern, z.B. Herzerkrankungen, Thromboembolien oder Herzmuskelentzündungen.
Das Virus verursacht eine systemische Endothelitis – eine Entzündung der Endothelzellen, welche alle Blutgefäße auskleiden. Dies verursacht schwere Durchblutungsstörungen in Herz, Hirn, Lunge, Nieren und Darm, was zu Herzschäden, Lungenembolien, Gefäßverschlüssen in Hirn und Darm, Multiorganversagen und sogar zum Tod führen kann.[2]Varga Z, Flammer AJ, Steiger P et al. (2020): Endothelial cell infection and endotheliitis in COVID-19. The Lancet 395: 10234, P1417-1418. Dabei werden die größten Schäden durch die Fehlreaktion des Immunsystems verursacht.
Zytokinsturm und Blutgerinnsel bei COVID-19
Patienten mit schwerem COVID-19-Krankheitsverlauf zeigen eine Fehl- und Überreaktion des Immunsystems, einen sogenannten „Zytokinsturm“. Zytokine sind Entzündungsbotenstoffe. Im Serum schwer kranker Personen wurden sehr hohe Konzentrationen des Interleukin-2-Rezeptors (IL-2R) und von Interleukin-6 (IL-6) gemessen, im Gegensatz zu leicht erkrankten Personen. Die beiden Serum-Zytokine sind demnach wichtige Marker für die Schwere des Krankheitsverlaufs.[3]Huaxia (2020): Increase of two serum cytokines may predict severity of COVID-19. URL: http://www.xinhuanet.com/english/2020-02/18/c_138795808.htm (02.03.2020)
Ein Zytokinsturm ist eine gefährliche Überreaktion des Immunsystems, die schwerwiegend bis tödlich verlaufen kann. Hohe Konzentrationen entzündungsrelevanter Zytokine werden gebildet, die wiederum Immunzellen dazu anregen, weitere Zytokine zu bilden. Die daraus resultierende Immunreaktion beruhigt sich nicht automatisch wieder, sondern schießt weit über das Ziel hinaus.
In der Klinik wird Cortison in Form von Dexamethason zur Behandlung des Zytokinsturms eingesetzt. Dieses sehr starke Immunsuppressivum hat bei beatmeten Patienten mit COVID-19 die meisten Leben gerettet, wie eine Studie aus Oxford belegt.[4]Horby P, Lim WS, Emberson J et al. (2020): Effect of Dexamethasone in Hospitalized Patients with COVID-19: Preliminary Report. MedRxiv Preprint. doi: https://doi.org/10.1101/2020.06.22.20137273. URL: … Continue reading Dies zeigt, dass die Menschen nicht am Virus versterben, sondern an der Überreaktion des eigenen Immunsystems. Durch die Blockade des eigenen Immunsystems kann das Überleben gesichert werden. Cortison, das den Zytokin- und Bradykinin-Sturm, aber auch das Immunsystem insgesamt hemmt, sollte allerdings nur im späteren Krankheitsstadium verabreicht werden, wenn es bereits zu einer Überreaktion des Immunsystems gekommen ist.
Virusinfektionen gehen häufig mit Thrombusbildung einher, beim Coronavirus scheint dieser Effekt aber besonders stark zu sein. Zytokine aktivieren die Blutgerinnung, weshalb schwere COVID-19-Fälle infolge des Zytokinsturms häufig unter Störungen der Blutgerinnung mit Bildung von Blutgerinnseln (Thrombusbildung) leiden. Während bei Schwerkranken ohne COVID-19 im Schnitt 1,3 % eine Lungenembolie erleiden, sind es bei schwerkranken COVID-19-Patienten ganze 30 %. Die Gerinnsel sind neben der Lungenentzündung ein zentraler Grund für die Schädigung der Lunge und tödliches Multiorganversagen.
Die entscheidende Rolle von Vitamin D zur Optimierung des Immunsystems und zur Milderung des Zytokinsturms ist inzwischen sehr gut belegt und wurde bereits in früheren Pressemitteilungen ausführlich thematisiert.[5]Benskin LL (2020): A Basic Review of the Preliminary Evidence That COVID-19 Risk and Severity Is Increased in Vitamin D Deficiency. Front Public Health; 8:513. Published 2020 Sep 10. … Continue reading Neue Studien zeigen, dass auch Vitamin K eine bedeutende Rolle zukommt und besonders bei schweren Verläufen ein ausgeprägter Mangel vorliegt, der den Calcium-Stoffwechsel stört und die Blutgerinnung fördert.

Sowohl der Zytokinsturm als auch die Azidose in Folge der Atemnot fördern die Blutgerinnung. Dabei spielt der gestörte Calcium-Stoffwechsel eine entscheidende Rolle.
Hypocalcämie bei COVID-19 – wohin verschwindet das Calcium?
Calcium ist das wichtigste Mineral im Knochen und essenziell für die Muskel- und Nervenfunktion. Im Säure-Basen-Haushalt spielt es eine besondere Rolle. So wird Calcium bei einer Übersäuerung aus den Knochen freigesetzt, um Säuren im Körper abzupuffern.[6]Vormann J, Goedecke T (2006): Acid-Base Homeostasis: Latent Acidosis as a Cause of Chronic Diseases. Schweiz Zschr GanzheitsMedizin; 18(5). Dies kann zu Calciumablagerungen in den Gefäßen führen. Besonders bedeutsam ist die Störung des Calcium-Haushalts im Rahmen der typischen Atemnot-bedingten Azidose bei COVID-19.
Calcium liegt im Blut normalerweise zu 45 % an Eiweiß gebunden und zu 50 % in freier, ionisierter Form vor. Calcium-Ionen werden als Gerinnungsfaktor IV klassifiziert und aktivieren die anderen Faktoren II, VII, IX, X und XIII. Freies Calcium ist der entscheidende Faktor im Start der Gerinnungskaskade. Ein Überschuss an freiem Calcium kann die Blutgerinnung übermäßig aktivieren, was zu potentiell tödlichen Blutgerinnseln führt.
Normalerweise verlaufen diese Verlagerungsprozesse von Calcium aus den Knochen in die Gefäßwände langsam und daher unbemerkt. Es entwickeln sich über Jahrzehnte Gefäßkalzifizierungen und Knochenschwund. Bei schweren akuten Erkrankungen passieren diese Veränderungen rapide. Daher ist eine Hypokalzämie bei kritisch kranken Patienten häufig.
Daher überrascht es nicht, dass bei COVID-19-Patienten eine Hypocalcämie sehr weit verbreitet ist. In zwei Studien wiesen 75 % bzw. 82 % aller Patienten bei der Krankenhausaufnahme zu niedrige Calcium-Spiegel im Blut (Hypocalcämie) auf.[7]Sun JK, Zhang WH, Zou L, et al. (2020): Serum calcium as a biomarker of clinical severity and prognosis in patients with coronavirus disease 2019. Aging (Albany NY).; 12(12):11287-11295. … Continue reading[8]Di Filippo L, Formenti AM, Rovere-Querini P, et al. (2020): Hypocalcemia is highly prevalent and predicts hospitalization in patients with COVID-19. Endocrine; 68(3):475-478. … Continue reading Patienten mit niedrigem Ca-Spiegel wiesen einen deutlich schlechteren Krankheitsverlauf auf. Sie hatten häufiger Organschäden, einen septischen Schock und eine höhere 28-Tage-Mortalität.[9]Sun JK, Zhang WH, Zou L, et al. (2020): Serum calcium as a biomarker of clinical severity and prognosis in patients with coronavirus disease 2019. Aging (Albany NY).; 12(12):11287-11295. … Continue reading
Azidose erhöht Sterblichkeit dramatisch
Beim Akuten Atemnotsyndrom, das bei COVID-19 häufig auftritt, kommt es im Blut zu einem Sauerstoffmangel, der Hypoxie. Gleichzeitig wird das Abatmen überschüssiger Säuren reduziert und saures Kohlendioxid reichert sich im Blut an. Zusammen mit den altersbedingt ohnehin bereits eingeschränkten Pufferfunktionen des Blutes führt dies unweigerlich zu einer Azidose, einer starken Übersäuerung des Blutes.
Laut einer in LANCET veröffentlichten Studie aus Wuhan leiden Patienten mit schwerem COVID-19-Krankheitsverlauf daher recht häufig unter einer dekompensierten Azidose. In der Studie hatten 30 % der Patienten, die an der Krankheit verstorben waren, eine Azidose (16 von 54), bei den Überlebenden war es nur 1 % (1 von 137).[10]Zhou F, Yu T, Du R et a. (2020): Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. The Lancet 395(10229). DOI: … Continue reading Die verstorbenen Patienten hatten fast alle Atemnot, Akutes Lungenversagen (ARDS) und Sepsis.
Die Diagnosekriterien für eine „Azidose“ erfassen die dekompensierte Azidose. Von den Patienten mit Atemnot dürfte ein viel größerer Anteil eine noch metabolisch kompensierte respiratorische Azidose aufweisen. Das Vorliegen einer dekompensierten Azidose sagte in der genannten Studie mit höchster Wahrscheinlichkeit einen tödlichen Krankheitsverlauf voraus: Ohne Azidose verstarben 22 % der Patienten, mit Azidose 94%. Die Sterbewahrscheinlichkeit war bei Vorliegen einer Azidose 16-fach erhöht. Je besser der Körper die respiratorische Azidose bei einer Atemnot noch mit Basenreserven puffern kann (und damit eine dekompensierte Azidose vermeiden kann), desto besser die Überlebenschancen. Die typischen Risikogruppen mit Diabetes und Nierenerkrankungen haben hier die schlechtesten Kompensationsmechanismen und versterben daher am häufigsten. Entsprechend häufig trat akutes Nierenversagen bei 50 % der Verstorbenen auf, bei den Überlebenden nur zu 1 %.
Patienten mit COVID-19 können Sauerstoffwerte aufweisen, die mit einem Leben ohne Atemnot eigentlich nicht vereinbar sind.[11]Tobin MJ, Laghi F, Jubran A (2020): Why COVID-19 Silent Hypoxemia Is Baffling to Physicians. Am J Respir Crit Care Med; 202(3):356-360. doi:10.1164/rccm.202006-2157CP Dieses Phänomen wird auch stille Hypoxie genannt und stellt ein besonderes Problem bei der Erkrankung dar: Die Patienten sind bereits viel kränker als es ihnen bewusst ist, da die Atemnot fehlt. Die stille Hypoxie erklärt zum Teil die plötzliche, rapide Verschlechterung des Gesundheitszustands der Patienten. Ein stiller Sauerstoffmangel ohne Atemnot kündigt eine starke Verschlechterung an. Bei einer COVID-19-Erkrankung ist es daher zentral, regelmäßig die Sauerstoffsättigung zu messen und bei Bedarf frühzeitig Sauerstoff zuzuführen. Entsprechende Pulsoxymeter (z.B. von Beurer) gibt es bereits für ca. 40 €. Sehr empfehlenswert und ohne Gerät möglich, ist die Überwachung der Atemzüge pro Minute. Normalerweise atme man 12 bis 16 Mal pro Minute. „Die Patienten, die in der Frühphase einer COVID-Lungenentzündung zu uns kommen, haben häufig eine Atemfrequenz von 22 bis 24 Zügen pro Minute, aber keine Luftnot.”, so die Lungenärzte im Netz.[12]Lungenärzte im Web (2020): Wie am besten Covid-19 zu Hause überwachen? URL: https://www.lungenaerzte-im-netz.de/news-archiv/meldung/article/wie-am-besten-covid-19-zu-hause-ueberwachen/ (15.01.2021)
Ursachen des Calciummangels
Bei einer Azidose wird das ionisierte Calcium im Blut verstärkt aufgebraucht, was zur Hypocalcämie führt. Typischerweise führt Atemnot zum Einstrom von extrazellulärem Calcium in die Endothel- und Myokardzellen, so dass der intrazelluläre Calcium-Spiegel stark ansteigt.[13]Brij SO, Peacock AJ (1998): Cellular responses to hypoxia in the pulmonary circulation. Thorax; 53:1075-1079. http://dx.doi.org/10.1136/thx.53.12.1075
Zusätzlich wird Calcium auch im Zuge der Virusvermehrung aufgebraucht: Calcium spielt eine zentrale Rolle bei Virusinfektionen und den replikativen Mechanismen von SARS-CoV, MERS-CoV und dem Ebolavirus. Calcium interagiert direkt mit Fusionspeptiden dieser Viren und fördert deren Replikation.[14]Di Filippo L, Formenti AM, Rovere-Querini P, et al. (2020): Hypocalcemia is highly prevalent and predicts hospitalization in patients with COVID-19. Endocrine; 68(3):475-478. … Continue reading
Freies Calcium wird auch direkt für die aktivierte Gerinnung aufgebraucht, aber beachtliche Mengen werden zudem von Bindegewebsfasern in Lunge und Gefäßen gebunden, die durch den Entzündungsprozess geschädigt werden.
Dass Entzündungen immer Kalzifizierungsprozesse zur Folge haben, ist seit langem in der Medizin bekannt. Die genauen Mechanismen treten nun bei COVID-19 besonders offensichtlich und lebensbedrohlich auf. (s.u.)
Die wichtigsten Ursachen des Calciummangels (Hypocalcämie) bei COVID-19 sind also:
- Calcium wird für die Virusvermehrung verbraucht.
- ACE2 und Bradykinin verlagern Calcium aus dem Blut in Muskel- und Endothelzellen.
- Durch Hypoxie/Azidose freigesetzes Calcium fällt als Calciumphosphat aus.
- Durch Hypoxie/Azidose freigesetzes Calcium aktiviert die Blutgerinnung.
- Durch Azidose gehen in der Zelle Kalium und Magnesium verloren, während sich Calcium, Natrium und Protonen anreichern. Folge: Reduktion des Membranpotentials und Zellödem.
- Entzündungsreaktionen senken den pH-Wert (lokale Azidose) und führen dort zur Calciumausfällung und Bildung von Calciumkristallen.
- Calcium bindet an entzündungsgeschädigte Bindegewebsfasern in Lunge und Gefäßen.
- Der sehr häufige Mangel an Vitamin K und D stört massiv den Calcium-Haushalt und begünstigt eine überschießende Entzündungsreaktion, Thrombenbildung sowie Bindegewebsschäden in Lunge und Gefäßen und erhöht stark die Mortalität.
Zu den weiteren möglichen Ursachen des gestörten Calcium-Stoffwechsels gehören u. a. eine Übersekretion von Parathormon, eine verminderte Nahrungsaufnahme, Hypoproteinämie, Hypomagnesiämie und Wechselwirkungen mit Medikamenten.[15]Kelly A, Levine MA (2011): Hypocalcemia in the Critically Ill patient. J Intensive Care Med.. 10.1177/0885066611411543. Zentral ist die sehr häufig Hypokaliämie.
Bradykinin und ACE2 verlagern Calcium in die Zellen
ACE2 und Bradykinin spielen eine zentrale Rolle bei COVID-19 (vgl. Pressemitteilung vom 18.11.2020). Beide verlagern das Calcium vom Serum in das Bindegewebe, in die Elastinfasern und in die Endothelzellen.[16]Pinheiro AR, Paramos-de-Carvalho D, Certal M, et al (2013): Bradykinin-induced Ca2+ signaling in human subcutaneous fibroblasts involves ATP release via hemichannels leading to P2Y12 receptors … Continue reading Zudem induziert der Entzündungsmediator Bradykinin die ATP-Ausschüttung von Fibroblasten, was zur Mobilisierung von intrazellulären Calciumspeichern führt. Der Anstieg des intrazellulären Calciums dient Fibroblasten als Signalmolekül.[17]Pinheiro AR, Paramos-de-Carvalho D, Certal M, et al (2013): Bradykinin-induced Ca2+ signaling in human subcutaneous fibroblasts involves ATP release via hemichannels leading to P2Y12 receptors … Continue reading
Bei COVID-19 wird auch eine Verletzung des Herzmuskels beobachtet. Dieser wird besonders durch ACE2, den Zytokinsturm und die Hypoxie geschädigt. Das exzessive intrazelluläre Calcium aufgrund der Atemnot führt zur Apoptose (Absterben) der Herzmuskelzellen.[18]ESC (European Society of Cardiology), 2020: ESC Guidance for the Diagnosis and Management of CV Disease during the COVID-19 Pandemic. URL: … Continue reading
Typisch für COVID-19 sind eine ausgeprägte Fatigue und Muskelschmerzen, die u. a. auch durch Bradykinin vermittelt werden.
Gefäßverkalkungen und Durchblutungsstörungen durch Hypoxie und Azidose
Die Azidose beim Akuten Atemnotsyndrom senkt den pH-Wert im Blut. Das Calcium wird infolgedessen aus seiner Proteinbindung freigesetzt und erhöht deutlich die Menge an freiem Calcium. Dieses aktiviert die Blutgerinnung und reagiert vermehrt mit dem Phosphat im Blut zu Calciumphosphat. Dies erklärt sich aus den biochemischen Eigenschaften der Moleküle und wird von Studien bestätigt, die nicht nur einen niedrigen Calcium-, sondern auch Phosphatwert im Serum aufzeigen. Patienten mit einem schweren Krankheitsverlauf hatten ein 7-fach höheres Risiko für niedrige Calciumwerte und ein 15-fach höheres Risiko für niedrige Phosphatwerte als Patienten mit einem mäßigen Verlauf, bei denen kein Sauerstoffmangel und Azidose auftraten.[19]Yang C, Ma X, Wu J, et al. (2020): Low serum calcium and phosphorus and their clinical performance in detecting COVID-19 patients [published online ahead of print, 2020 Sep 14]. J Med Virol.; … Continue reading Das Calciumphosphat fällt aus und kann sich als Salz ablagern: Die Gefäße und deren Bindegewebsfasern verkalken.
Treten bei den verengten Gefäßen unter Belastung nun lokal Durchblutungsstörungen (Ischämien) auf, steigt dort die Glykolyse und damit die Milchsäureproduktion stark an. Diese hat zur Folge, dass es bei der reduzierten Pufferkapazität im betroffenen Areal zu einem noch viel stärkeren pH-Wert-Abfall kommt. Durch die Azidose kommt es zum Verlust von Kalium und Magnesium in der Zelle, während sich Calcium, Natrium und Protonen anreichern. Die Folgen sind eine Reduktion des Membranpotentials und ein Zellödem. Dies betrifft unter anderem die Lungen- und Myokardzellen, deren Funktion in der Folge stark beeinträchtigt ist.

Bei den roten Blutkörperchen führen die beschriebenen Veränderungen bei einer Azidose zum Phänomen der „Azidosestarre der Erythrozyten“. Sie quellen durch Wasser und Elektrolytverschiebungen auf, sind nicht mehr verformbar und behindern dadurch die Mikrozirkulation.[20]Jacob LM (2013): Dr. Jacobs Weg des genussvollen Verzichts: Die effektivsten Maßnahmen zur Prävention und Therapie von Zivilisationskrankheiten. 3. Auflage. Nutricamedia, Heidesheim am Rhein. Dieser Mechanismus verstärkt die Entstehung eines Gefäßverschlusses.

Lungenobduktionen von Patienten, die an COVID-19-assoziiertem Atemversagen verstorben sind, zeigen in den Lungen eine diffuse alveoläre Schädigung sowie schwere endotheliale Schäden. Bei den Lungengefäßen zeigt sich eine weit verbreitete Thrombose mit Mikroangiopathie sowie eine vermehrte Angiogenese.[21]Ackermann M, Verleden SE, Kuehnel M, et al. (2020): Pulmonary Vascular Endothelialitis, Thrombosis, and Angiogenesis in Covid-19. N Engl J Med; 383(2):120-128. doi: 10.1056/NEJMoa2015432. Epub 2020 … Continue reading Dabei treten sowohl kapilläre Mikrothromben als auch Makrothromben auf.[22]Borczuk AC, Salvatore SP, Seshan SV, et al. (2020): COVID-19 pulmonary pathology: a multi-institutional autopsy cohort from Italy and New York City. Mod Pathol; 33(11):2156-2168. … Continue reading
Zur Behandlung einer Azidose wird häufig Natriumbicarbonat eingesetzt. Dieses trägt bei schwerer metabolischer Azidose aber nicht zur Senkung der Mortalitätsrate bei.[23]Jaber S, Paugam C, Futier E, et al. (2018): Sodium bicarbonate therapy for patients with severe metabolic acidaemia in the intensive care unit (BICAR-ICU): a multicentre, open-label, randomised … Continue reading Das Bicarbonat wirkt zwar gegen die Übersäuerung, aber das Natrium verstärkt die Elektrolytverschiebungen in der Zelle. Es fördert die Bildung von Zellödemen und das Sinken des Membranpotentials. Diese unerwünschten Nebenwirkungen gleichen die positiven Wirkungen des Bicarbonats aus.
Entzündungen und Azidose – ein effektiver Teufelskreis
Jede Entzündungsreaktion senkt den Gewebe-pH-Wert und fördert die Ausfällung und Kristallisierung von Calcium. Gleichzeitig fördert der niedrige pH-Wert die Entzündung – ein effektiver Teufelskreis. Der niedrige pH-Wert sorgt auch maßgeblich für den typischen Entzündungsschmerz, wenn entsprechende Schmerzrezeptoren, sogenannte säuremessende Ionenkanäle, vorhanden sind. Jede größere Entzündung hinterlässt daher Verkalkungen. (Im Falle der Tuberkulose wird das z. B. im Röntgenbild diagnostisch genutzt.) Diesem zentralen Phänomen ist ein separater Artikel gewidmet. Wie massiv bei COVID-19 Entzündungsreaktionen sein können, zeigt sich u. a. am Zytokinsturm.
Cholesterinansammlungen aktivieren Makrophagen und Entzündungsprozesse und verstärken damit auch die Kalzifizierung. Krankheiten, die mit einer chronischen Entzündung und Kalzifizierungsprozessen einhergehen, werden durch erhöhte Cholesterinspiegel daher verschlimmert.[24]Yvan-Charvet L, Bonacina F, Guinamard RR, Norata GD. Immunometabolic function of cholesterol in cardiovascular disease and beyond. Cardiovasc Res. 2019;115(9):1393-1407. doi:10.1093/cvr/cvz127
COVID-19 kann eine Ketoazidose mit stark erhöhter Mortalität auslösen
COVID-19-Patienten mit und ohne Diabetes entwickeln relativ häufig eine Ketose und Ketoazidose, welche den Verlauf und die Mortalität deutlich verschlimmert. Die Ketose erhöht die Dauer des Krankenhausaufenthalts und die Sterblichkeit.[25]Li J, Wang X, Chen J, Zuo X, Zhang H, Deng A (2020): COVID-19 infection may cause ketosis and ketoacidosis. Diabetes Obes Metab; 22(10):1935-1941. doi:10.1111/dom.14057
Kaliummangel ist häufig und fördert kardiovaskuläre Komplikationen
Neben einer Hypocalciämie ist auch eine Hypokaliämie bei Patienten mit COVID-19 sehr häufig. Die zentrale Bedeutung von Kalium, des wichtigsten Elektrolyts in jeder Zelle, wird immer noch oft unterschätzt. Ein Großteil der Bevölkerung ist schon vor einer COVID-Erkrankung stark unterversorgt, da die Hauptquelle pflanzliche Rohkost wie Gemüse und Obst sind.
In Deutschland gilt eine neue Zufuhrempfehlung von 4 g Kalium pro Tag, in den USA seit Jahrzehnten von 4,7 g. Rund ein Drittel der Zellenergie wird dafür aufgewendet, mittels der Natrium-Kalium-Pumpe Kalium in die Zelle und Natrium aus der Zelle zu pumpen, um das Membranpotential aufrecht zu erhalten. Denn Kalium bestimmt das Membranpotential, das die Basis der „Zellbatterie“ darstellt und zahllose zentrale Zellprozesse ermöglicht. Kalium normalisiert den Blutdruck, ist wichtig für die Endothel-Gefäßgesundheit, reguliert den Herzrhythmus und senkt stark das Schlaganfallrisiko. Kaliumcitrat schützt die Nieren und erhält die Knochensubstanz, indem es u.a. die Calciumausscheidung senkt.[26]Jacob LM (2013): Dr. Jacobs Weg des genussvollen Verzichts: Die effektivsten Maßnahmen zur Prävention und Therapie von Zivilisationskrankheiten. 3. Auflage. Nutricamedia, Heidesheim am Rhein.
Der massive Kaliumverlust bei COVID-19 beruht zum einen auf einer gestörten Aktivität des Renin-Angiotensin-Systems. SARS-CoV-2 bindet an das Angiotensin-konvertierende Enzyms 2 (ACE2) und fördert dessen Abbau. Daher ist die Gegenaktivität von ACE2 auf das Renin-Angiotensin-System reduziert. Dies führt zu einer vermehrten Rückresorption von Natriumchlorid und Wasser sowie Ausscheidung von Kalium, was den Blutdruck erhöht. Zusätzlich haben COVID-19-Patienten häufig gastrointestinale Symptome wie Durchfall und Erbrechen, was zu Störungen im Elektrolythaushalt führen kann.[27]Chen D, Li X, Song Q, et al. (2020): Assessment of Hypokalemia and Clinical Characteristics in Patients With Coronavirus Disease 2019 in Wenzhou, China. JAMA Netw Open; 3(6):e2011122. Published 2020 … Continue reading
Bei Hypokaliämie neigt das Herz zu Rhythmusstörungen, die häufig aus Extrasystolen bestehen, aber auch mit Vorhofflimmern und Kammerflimmern, bis hin zum Herzstillstand und Tod, einhergehen können. Herzrhythmusstörungen sind bei COVID-19-Patienten häufig und erhöhen deutlich die Sterblichkeit. Typische Folge einer Hypokaliämie sind neben Herzarrhythmien auch Muskelschwäche, Hypercalciurie, Insulinresistenz, Bluthochdruck und ein stark erhöhtes Schlaganfall-Risiko.
Die Wiederherstellung der Kaliumspeicher sollte allerdings nicht mit säurebildendem Kaliumchlorid, sondern mit basenbildendem Kaliumcitrat erfolgen, da eine weitere wesentliche Ursache des Kaliummangels eine anhaltende Azidose ist. Eine akute Azidose verlagert Kalium aus den Zellen (im Austausch mit Protonen) ins Blut und kann kurzfristig zu einer Hyperkaliämie führen. Dieses Kalium geht rasch über die Nieren endgültig verloren. Daher sind für eine anhaltende Azidose niedrige Kaliumwerte auch im Serum typischer. Dies spiegelt einen ausgeprägten Kaliummangel in den Zellen UND im Serum wider.
Magnesiummangel schwächt Immunsystem und fördert kardiovaskuläre Komplikationen
Magnesium ist DER natürliche Calcium-Antagonist und mildert die allerseits überschießende Calcium-Reaktion ab. Auch für die Vitamin-D-Wirkung spielt Magnesium eine zentrale Rolle.
Eine Hypomagnesiämie ist bei Intensivpatienten häufig mit einer Prävalenz von bis zu 65 %.[28]Micke O, Vormann J, Kisters K (2020): Magnesium deficiency and COVID-19 – What are the links?Some remarks from the German Society for Magnesium Research e.V. Trace Elements and Electrolytes, Vol. … Continue reading Herzrhythmusstörungen treten bei schweren COVID-19-Verläufen häufig auf und sind auch durch den Mangel an Kalium und Magnesium verursacht. Typisch ist im EKG eine QT-Verlängerung.[29]Prutkin JM (2020): Coronavirus disease 2019 (COVID-19): Arrhythmias and conduction system disease. www.uptodate.com/contents/coronavirus-disease-2019-covid-19-arrhythmias-and-conduction-system-disease
Magnesium spielt aber auch direkt für das Immunsystem eine wichtige Rolle. Bei einem Magnesiummangel sind zahlreiche Immunfunktionen gestört. Die Konzentration des intrazellulären freien Magnesiums trägt erheblich zur antiviralen Immunität bei. Ein Magnesiummangel trägt zur chronischen niedriggradigen Entzündung bei und ist daher ein Risikofaktor für verschiedene pathologische Zustände wie Herz-Kreislauf-Erkrankungen, Bluthochdruck und Diabetes. Die ergänzende Einnahme von Magnesium konnte in Studien das C-reaktive Protein reduzieren.[30]Micke O, Vormann J, Kisters K (2020): Magnesium deficiency and COVID-19 – What are the links?Some remarks from the German Society for Magnesium Research e.V. Trace Elements and Electrolytes, Vol. … Continue reading
Wie Vitamin-K-Mangel die Blutgerinnung und Calcium-Störungen fördert
Schon länger ist bekannt, dass ein starker Vitamin-K-Mangel bei schwerkranken Patienten als disseminierte intravasale Gerinnung fehldiagnostiziert werden kann. Diese tritt auch bei der Mehrheit der COVID-19-Krankenhauspatienten auf. Thromboembolien und mikrovaskuläre Thrombosen sind bei schweren Covid-19-Verläufen häufig und eine führende Todesursache.[31]Janssen R, Visser MPJ, Dofferhoff ASM, Vermeer C, Janssens W, Walk J (2020): Vitamin K metabolism as the potential missing link between lung damage and thromboembolism in Coronavirus disease 2019. … Continue reading
Die niederländische Studie von Janssen und Mitarbeitern nahm daher die häufig tödlich verlaufende Bildung von Blutgerinnseln bei COVID-19-Patienten zum Anlass, den Vitamin-K-Status dieser Patienten zu analysieren. Als Marker für den Vitamin-K-Status wurde uncarboxyliertes Matrix-Gla-Protein (uc-MGP) im Blut herangezogen. Vitamin K sorgt für die Carboxylierung von MGP – herrscht ein Mangel an Vitamin K, so gibt es ein Übermaß an uc-MGP. Werte für Dp-ucMGP unter 300 pmol/L bezeichnen die Autoren der Studie als gesunde Normwerte. Werte über 500 pmol/l spiegeln einen Vitamin-K-Mangel wider.[32]Dofferhoff ASM, Piscaer I, Schurgers LJ et al. (2020): Reduced Vitamin K Status as a Potentially Modifiable Prognostic Risk Factor in COVID-19. Clinical Infectious Diseases, ciaa1258, … Continue reading
Es zeigte sich, dass COVID-19-Patienten signifikant mehr uc-MGP im Blut hatten als Kontrollpersonen (durchschnittlich 1673 vs. 536 pmol/l). COVID-19-Patienten mit schweren Verläufen hatten zudem höhere uc-MGP-Werte als diejenigen mit leichten Verläufen (durchschnittlich 2087 vs. 1299 pmol/l). Demnach wiesen COVID-19-Patienten einen stark reduzierten Vitamin-K-Status auf. Je schwerer der COVID-19-Verlauf, desto stärker war der Vitamin-K-Mangel.[33]Dofferhoff ASM, Piscaer I, Schurgers LJ et al. (2020): Reduced Vitamin K Status as a Potentially Modifiable Prognostic Risk Factor in COVID-19. Clinical Infectious Diseases, ciaa1258, … Continue reading
Auch eine dänische Studie ergab, dass der ucMGP-Spiegel bei COVID-19-Patienten im Krankenhaus signifikant höher war als bei gesunde Kontrollpersonen (1022 vs. 509 pmol/l), d.h. der Vitamin-K-Status war bei der Erkrankten deutlich schlechter. Zusätzlich zeigte sich, dass der ucMGP-Wert bei den verstorbenen Patienten signifikant höher war als bei den Überlebenden (1445 vs. 877 pmol/l). Ein niedriger Vitamin-K-Status sagte demnach eine höhere Sterblichkeit voraus, was den Einfluss von Vitamin K bei COVID-19 unterstützt.[34]Linneberg A, Kampmann FB, Israelsen SB, Andersen LR, Jørgensen HL, Sandholt H, Jørgensen NR, Thysen SM, Benfield T (2020): Low vitamin K status predicts mortality in a cohort of 138 hospitalized … Continue reading
Ursächlich für den schweren Vitamin-K-Mangel bei COVID-19-Patienten ist auch ein erhöhter Vitamin-K-Verbrauch im Rahmen der Lungenentzündung, wodurch die Vitamin-K-Speicher entleert werden.[35]Janssen R, Visser MPJ, Dofferhoff ASM, Vermeer C, Janssens W, Walk J (2020): Vitamin K metabolism as the potential missing link between lung damage and thromboembolism in Coronavirus disease 2019. … Continue reading
Laut einer weiteren Studie ist ein Vitamin-K-Mangel bei COVID-19-Patienten häufig und bei männlichen Patienten weiter verbreitet als bei weiblichen. Bei einem starken Vitamin-K-Mangel lässt sich eine Korrelation mit erhöhten Entzündungsmarkern (IL-6) erkennen. Dies deutet darauf hin, dass Vitamin K ein wichtiger und einfach behebbarer Risikofaktor für einen schweren Krankheitsverlauf von COVID-19 ist.[36]Anastasi E, Ialongo C, Labriola R, Ferraguti G, Lucarelli M, Angeloni A (2020): Vitamin K deficiency and covid-19, Scandinavian Journal of Clinical and Laboratory Investigation, … Continue reading
Ein hoher uc-MGP-Wert, der für eine schlechte Vitamin-K-Versorgung steht, steht zudem mit verschiedenen gesundheitlichen Risikofaktoren in Zusammenhang, die auch bei COVID-19 das Risiko für einen schweren Krankheitsverlauf erhöhen.
In der Studie von Pivin et al. wurden 1001 Studienteilnehmer anhand ihres uc-MGP-Wertes in drei Tertile eingeteilt.[37]Pivin E, Ponte B, Pruijm M et al. (2015): Inactive Matrix Gla-Protein Is Associated With Arterial Stiffness in an Adult Population-Based Study. Hypertension; 66(1):85-92. doi: … Continue reading Die Probanden des unteren Tertils hatten uc-MGP-Werte unter 320 pmol/l, im mittleren Tertil lag der Wert bei 320-500 pmol/l und im oberen Tertil bei über 500 pmol/l.
Mit steigender Kategorie, also höherem dp-ucMGP-Wert, hatten die Probanden häufiger Diabetes mellitus, Schlaganfall oder Herzinfarkt in der Vorgeschichte oder nahmen blutdrucksenkende Medikamente. Auch Alter, BMI, Blutdruck, LDL-Cholesterin und die Pulswellengeschwindigkeit (ein Marker für die Arteriensteifheit) gingen mit höheren Werten an uc-MGP und damit Vitamin-K-Mangel einher.
Klare Referenzwerte für uc-MGP liegen leider nicht vor. Die Studie lässt jedoch annehmen, dass Werte unter 320 pmol/l als wünschenswert zu betrachten sind und Werte über 500 pmol/l auf einen Vitamin-K-Mangel hindeuten. Dies bestätigt die Einschätzung von Dofferhoff et al. (s.o.).[38]Dofferhoff ASM, Piscaer I, Schurgers LJ et al. (2020): Reduced Vitamin K Status as a Potentially Modifiable Prognostic Risk Factor in COVID-19. Clinical Infectious Diseases, ciaa1258, … Continue reading
Vitamin K2 wirkt auch gerinnungshemmend, indem es c-MGP und endotheliales Protein S aktiviert
Matrix-Gla-Protein (c-MGP) bindet überschüssiges Calcium.[39]Schurgers LJ, Barreto DV, Barreto FC, Liabeuf S, Renard C, Magdeleyns EJ, Vermeer C, Choukroun G, Massy ZA (2010): The circulating inactive form of matrix gla protein is a surrogate marker for … Continue reading Ist zu wenig Vitamin K vorhanden, wird auch weniger calcium-bindendes MGP aktiviert, so dass das freie Calcium im Blut für Blutgerinnung und andere Zwecke aufgebraucht wird.
Vitamin K aktiviert nicht nur gerinnungsfördernde, sondern auch gerinnungshemmende Faktoren in der Leber. Es wirkt somit regulierend auf die Gerinnungsfunktion. Vitamin K aktiviert die hepatischen Gerinnungsfaktoren II, VII, IX and X sowie die gerinnungshemmenden Proteine C und S.
Bei einem Vitamin-K-Mangel werden vorrangig gerinnungsfördernde Faktoren in der Leber produziert – auf Kosten anderer Vitamin-K-abhängiger Proteine. Dies wird auch Triage-These genannt.[40]Janssen R, Visser MPJ, Dofferhoff ASM, Vermeer C, Janssens W, Walk J (2020): Vitamin K metabolism as the potential missing link between lung damage and thromboembolism in Coronavirus disease 2019. … Continue reading Vitamin K wird sowohl für die Bildung als auch für die Aktivierung von Protein S benötigt. Das Vitamin-K-abhängige Protein S hemmt die Blutgerinnung und spielt bei der Prävention von lokalen Thrombosen eine zentrale Rolle. Bei einem Vitamin-K-Mangel ist die wichtige Funktion des Protein S bei COVID-19 beeinträchtigt, was die verstärkte Thrombusbildung mit erklärt.[41]Janssen R, Visser MPJ, Dofferhoff ASM, Vermeer C, Janssens W, Walk J (2020): Vitamin K metabolism as the potential missing link between lung damage and thromboembolism in Coronavirus disease 2019. … Continue reading
An der Oberfläche der Endothelzellen fördert das Protein S den Vitamin-K-abhängigen Gerinnungsfaktor V. Im Gegensatz zu anderen Vitamin-K-abhängigen Gerinnungsfaktoren wird das Protein S nicht nur in der Leber, sondern zur Hälfte außerhalb der Leber in Endothelzellen produziert. Dieser Tatsache kommt eine besondere Bedeutung bei der lokalen Prävention von Thrombosen zu. Vitamin K2 in Form von all-trans MK7 hat eine etwa 50-mal längere Halbwertszeit als Vitamin K1, weshalb es vor allem bei allen Effekten außerhalb der Leber deutlich wirkungsvoller ist.
Vitamin K gegen Entzündungen
Protein S wirkt nicht nur gerinnungshemmend, sondern auch antientzündlich, indem es u. a. Prostaglandin E2 (PGE2), Cyclooxygenase-2 (COX-2) und Interleukin-6 senkt.[42]Suleiman L, Negrier C, Boukerche H (2013): Protein S: a multifunctional anticoagulant vitamin K-dependent protein at the crossroads of coagulation, inflammation, angiogenesis, and cancer. Crit Rev … Continue reading Ein hoher Vitamin-K-Status hemmt auch den Entzündungsfaktor NFκB. Vitamin K kann zudem antioxidativ wirken, indem es die Ansammlung von reaktiven Sauerstoffspezies blockiert, die ebenfalls zur Entzündung beitragen.
Ergänzende Wirkungen von Vitamin E und Vitamin A gegen COVID-19
Vitamin A spielt eine sehr wichtige Rolle bei viralen Erkrankungen. Ein Vitamin-A-Mangel zeigt sich zuallererst in den Schleimhäuten der Atemwege. Vitamin A steuert über die Regulation von Genaktivitäten Wachstum und Entwicklung von Schleimhautzellen des Respirations- und Magen-Darm-Trakts. Die Konsequenz eines Vitamin-A-Mangels ist eine höhere Infektanfälligkeit und durch sich wiederholende Infekte zudem ein höherer Vitamin-A-Verbrauch. Dies wiederum verstärkt einen bestehenden Mangel.[43]Biesalski HK, Bischoff SC, Pirlich M, Weimann A (Hrsg.) (2017): Ernährungsmedizin. 5., vollständig überarbeitete und erweiterte Auflage. Stuttgart: Thieme. doi:10.1055/b-004-132260 Zudem hat Vitamin A die Fähigkeit bereits geschulte Immunzellen aus dem Organismus in die Darmschleimhaut zurückzuholen.[44]Cantorna MT, Snyder L, Arora J (2019): Vitamin A and vitamin D regulate the microbial complexity, barrier function, and the mucosal immune responses to ensure intestinal homeostasis. Crit Rev Biochem … Continue reading Ebenso interessant: Die zwei Vitamine D und A sind voneinander abhängig, da die Rezeptoren des Vitamin-D-Hormons (VDR) und des Vitamin-A-Hormons (RXR) beim Ablesen eines Gens miteinander verschmelzen.
Gerade bei einer Virusinfektion der Atemwege ist die zusätzliche Aufnahme von Vitamin A sehr empfehlenswert, weil der Vitamin-A-Bedarf durch die Infektion stark ansteigt. Gröber und Kollegen empfehlen in der Prävention die Supplementierung von 30–50 internationalen Einheiten (IE) Retinol pro kg Körpergewicht und Tag.[45]Gröber U, Holzhauer P, Kisters K (2020): Immunrelevante Mikronährstoffe bei viralen Atemwegsinfektionen. DZO; 52: 51-56. DOI: 10.1055/a-1162-2469
Vitamin E – am besten in Form natürlicher Tocopherole – wirkt zwar nicht antiviral, kann aber vor Folgeschäden einer Virusinfektion schützen. Denn diese lösen Entzündungen und damit starken oxidativen Stress aus. Das fettlösliche Vitamin E fängt die freien Radikale ab, weshalb im Fall einer Infektion der Vitamin-E-Bedarf erhöht ist. Dadurch kann es wichtige Organe, wie z. B. Lunge und Leber, vor Schäden schützen.[46]Mileva M, Galabov AS (2018): Vitamin E and Influenza Virus Infection, Vitamin E in Health and Disease, Morales-Gonzalez JA, IntechOpen. DOI: 10.5772/intechopen.80954
Die verstärkte Bildung von Blutgerinnseln ist eine der Haupttodesursachen bei COVID-19. Vitamin E schützt vor Blutgerinnseln. Insbesondere gamma-Tocopherol reduziert die Thrombozytenaggregation und verzögert die arterielle Thrombusbildung. Laut einer Studie an 40.000 Frauen wurde bei Frauen mit dem häufigen Faktor-V-Leiden bei einer Dosis von 600 I.E. Vitamin E das Thromboserisiko um 49 % gesenkt, bei allen anderen um 21-27%.[47]Glynn RJ, Ridker PM, Goldhaber SZ, Zee RY, Buring JE (2007): Effects of random allocation to vitamin E supplementation on the occurrence of venous thromboembolism: report from the Women’s … Continue reading Zum Teil wird diese Wirkung dadurch vermittelt, dass Vitamin E die Umwandlung von Vitamin K1 in aktives Vitamin K2 (MK4) verhindert. Dies ist allerdings nicht der Fall bei Vitamin K2 als MK7, da dieses direkt wirkt und nicht umgewandelt werden muss.[48]Ikeda S, Hanzawa F, Takahashi S, Suzuki N, Sano K, Oda H, Uchida T. Tissue Distribution of Menaquinone-7 and the Effect of α-Tocopherol Intake on Menaquinone-7 Concentration in Rats. J Nutr Sci … Continue reading
Gamma-Tocopherol hat zudem einen positiven Einfluss auf die Bildung von bioaktivem NO (Stickstoffmonoxid), das die Endothelfunktion verbessert, die Gefäße erweitert und auch der Virenabwehr dient.[49]Singh I, Turner AH, Sinclair AJ, Li D, Hawley JA (2007): Effects of gamma-tocopherol supplementation on thrombotic risk factors. Asia Pac J Clin Nutr.; 16(3):422-428.
Der Körper benötigt Vitamin E auch zur Stärkung seines Immunsystems, damit es eindringende Bakterien und Viren abwehren kann.
Die Vitamine A und E können daher sinnvolle Ergänzungen zu Vitamin D und Vitamin K sein, um Atemwegserkrankungen wie COVID-19 vorzubeugen und den Krankheitsverlauf einer bestehenden Erkrankung positiv zu beeinflussen.
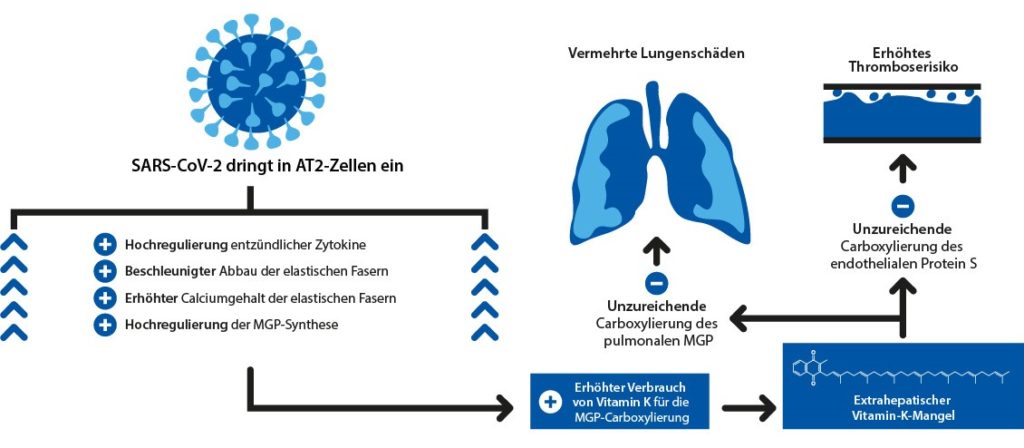
Die unterschätzte Bedeutung der elastischen Fasern und von MGP
In der aktuellen Studie von Janssen et al. wird die Bedeutung von Vitamin K, MGP und elastischen Bindegewebe auf den Verlauf von COVID-19 klug thematisiert und mit klinischen Daten untermauert.[50]Janssen R, Visser MPJ, Dofferhoff ASM, Vermeer C, Janssens W, Walk J (2020): Vitamin K metabolism as the potential missing link between lung damage and thromboembolism in Coronavirus disease 2019. … Continue reading Die folgenden Ausführungen beruhen auf der klinischen Studie von Janssen und den zahlreichen darin zitierten Originalstudien. Besonders interessant ist, dass sich die beschriebenen Prozesse analog auf viele andere Entzündungsprozesse übertragen lassen.
Elastische Fasern sind ein kritischer Bestandteil der extrazellulären Matrix (Bindegewebe). Sie sorgen für die Verformbarkeit und damit für die Flexibilität und Belastbarkeit von Lunge und Arterien. Konkret ermöglichen sie erst die normale Funktion von Atmung und Blutkreislauf. Das Gleichgewicht zwischen Abbau und Reparatur elastischer Fasern ist von entscheidender Bedeutung für die Gesundheit des Herzens und der Lunge, die beide am stärksten von Covid-19 betroffen sind.
Entzündungen fördern die Verkalkung der elastischen Fasern und führen so zu einem Teufelskreis aus deren Verkalkung und Abbau:
Die Affinität der elastischen Fasern für Calcium ist biochemisch bedingt hoch. Teilweise abgebaute elastische Fasern sind negativer geladen und ziehen positiv geladenes Calcium an. Calciumphosphat wird in Form von Kristallen in die Fasern eingelagert. Diese Verkalkungen beeinträchtigen die Funktion der Fasern erheblich. Die Verkalkung elastischer Fasern und proteolytische Abbauprozesse sind eng miteinander verbunden sind. Mit steigendem Calcium-Gehalt der elastischen Fasern wird auch die Synthese von Matrix-Metalloproteinasen hochreguliert. Dies sind proteolytische Enzyme, die Elastinfasern abbauen und damit für die Kalzifizierung anfällig machen.
Matrix Gla Protein (MGP) ist ein Vitamin K-abhängiger Hemmer der Verkalkung der Weichgewebe (z. B. Blutgefäße, Lunge) und schützt auch vor dem Abbau der elastischen Fasern. MGP kann in das Lumen der elastischen Fasern eindringen und spielt eine entscheidende Rolle beim Schutz des elastischen Gewebes vor Mineralisierung. Auch andere kalziumbindende Proteine sind abhängig von Vitamin K. In den Knochen baut Osteocalcin Calcium in die Knochenmatrix ein. In Weichteilen wie Blutgefäßen oder der Lunge verhindert MGP Kalziumablagerungen, den Abbau von elastischen Fasern, Thrombose und Entzündungen. Dies schützt vor Lungenschäden und einer Versteifung der Blutgefäße.
Partiell degradierte und mineralisierte elastische Fasern – wie sie bei Diabetikern, Hypertonikern, Nieren- und Herz-Kreislauf-Patienten häufig vorkommen – sind anfälliger für weitere Proteolyse und Kalzifizierung. Dies erhöht den Bedarf an MGP-Synthese zum Schutz der elastischen Fasern, was die Vitamin-K-Speicher für die MGP-Carboxylierung entleert und zu höheren uc-MGP-Spiegeln führt.
Nur das durch Vitamin K carboxylierte und damit aktivierte MGP (c-MGP) ist biologisch wirksam, das uncarboxylierte uc-MGP ist biologisch wertlos.
Sowohl bei Gefäßerkrankungen als auch in der Allgemeinbevölkerung sind erhöhte uc-MGP-Spiegel mit einer höheren Gesamtmortalität assoziiert. Eine Vitamin-K-Supplementierung reduziert die uc-MGP-Spiegel und hat einen günstigen Effekt auf das Fortschreiten klinischer Zielgrößen wie Aortenklappenverkalkung, arterielle Steifigkeit und Knochenabbau.
In der Lunge von COVID-19-Patienten tritt eine spezifische Untergruppe von Makrophagen auf, die nachweislich Matrix-Metalloproteinasen-9 produziert. Dies könnte der Grund dafür sein, dass sich bei einer SARS-CoV-2-Infektion der Abbau der elastischen Fasern so stark beschleunigt.
Bei COVID-19-Patienten besteht ein starker Zusammenhang zwischen uc-MGP und dem Abbau der elastischen Fasern. Eine mögliche Ursache hierfür ist, dass die elastischen Fasern aufgrund der vermehrten Proteolyse in COVID-19-Lungen anfälliger für den Einbau von Calcium sind. Dies führt zu einer Hochregulierung der MGP-Synthese und einer Erschöpfung der Vitamin-K-Speicher. Dieser Mangel beeinträchtigt die MGP-Aktivierung, was zu einer weiteren Schädigung der elastischen Fasern und einer Erhöhung des zirkulierenden uc-MGP führt. Die Abbaurate der elastischen Fasern ist mit einem schlechten Krankheitsverlauf bei Patienten mit SARS-CoV-2-Pneumonie assoziiert. Soweit Janssen et al..[51]Janssen R, Visser MPJ, Dofferhoff ASM, Vermeer C, Janssens W, Walk J (2020): Vitamin K metabolism as the potential missing link between lung damage and thromboembolism in Coronavirus disease 2019. … Continue reading
Vitamin-D-Toxizität aufgrund von Vitamin-K-Mangel?
Die Toxizität einer Vitamin-D-Überdosierung besteht immer im Kalzifizierungsprozessen, was zeigt, dass hier ein starker Zusammenhang mit Vitamin-K-Mangel und Calciumüberschuss besteht.
Vitamin D und Vitamin K wirken einerseits synergistisch, weil sie beide zusammen für einen gesunden Calcium-Stoffwechsel sorgen, andererseits auch antagonistisch. Denn hohe Dosen Vitamin D können zum Aufbrauchen der extrahepatischen Vitamin-K-Speicher führen, da die MGP-Synthese erhöht wird. Dies kann zu einer Hypercalcämie, zur beschleunigten Verkalkung der Blutgefäße oder der elastischen Fasern sowie zu einem verstärkten Abbau der elastischen Fasern führen. Auch die Bildung von Nierensteinen oder Nierenverkalkung sind möglich.
Je höher die Zufuhr an Calcium (vor allem als Calciumphosphat wie in Milchprodukten) ist und je niedriger der Vitamin-K-Status, desto eher können bei Vitamin D diese Nebenwirkungen auftreten. (Sicher gilt bei Erwachsenen die tägliche Zufuhr von 4000 I.E.)
Die hochdosierte Zufuhr von Vitamin D kann laut Janssen et al. bei einem Vitamin-K-Mangel daher die Gesundheit von Lunge und Gefäßen gefährden und sollte bei Personen mit entsprechenden Risikofaktoren und bei COVID-19 immer mit der Einnahme von Vitamin K ergänzt werden.[52]Janssen R, Visser MPJ, Dofferhoff ASM, Vermeer C, Janssens W, Walk J (2020): Vitamin K metabolism as the potential missing link between lung damage and thromboembolism in Coronavirus disease 2019. … Continue reading
Vitamin-K-Formen
Vitamin K gibt es in zwei unterschiedlichen Formen: Vitamin K1 (Phyllochinon) und Vitamin K2 (Menachinon). In Lebensmitteln wie grünem Blattgemüse ist reichlich Vitamin K1 enthalten. Der Großteil des aufgenommenen Vitamin K1 wird in der Leber für die Blutgerinnung verbraucht. Zudem hat Vitamin K1 eine sehr kurze Halbwertszeit von 1,5 Stunden.[53]Schurgers LJ, Teunissen KJ, Hamulyák K, Knapen MH, Vik H, Vermeer C (2007): Vitamin K-containing dietary supplements: comparison of synthetic vitamin K1 and natto-derived menaquinone-7. Blood; … Continue reading Dies erklärt, warum Vitamin K1 nur geringfügige extrahepatische Vitamin-K-Wirkungen aufweist.
Vitamin K2 hat eine deutlich bessere Stabilität im Körper, insbesondere in Form des all-trans Menachinon-7 (all-trans MK-7). Mit einer Halbwertszeit von ca. 3 Tagen hat es eine etwa 50-mal längere Wirkdauer als Vitamin K1 und erreicht es jeden Teil des Körpers.[54]Schurgers LJ, Teunissen KJ, Hamulyák K, Knapen MH, Vik H, Vermeer C (2007): Vitamin K-containing dietary supplements: comparison of synthetic vitamin K1 and natto-derived menaquinone-7. Blood; … Continue reading Daneben hat das langkettige Menachinon-7 eine außergewöhnlich hohe Bioverfügbarkeit und wird vom Körper optimal aufgenommen. Natürlich kommt es nur reichlich in Natto (speziell fermentierten Sojabohnen) vor.
Zahlreiche klinische Studien belegen, dass Vitamin K2 (MK7) vor allem in Bezug auf die Wirkungen außerhalb der Leber K1 deutlich überlegen ist und Effekte erzielt, die mit Vitamin K1 nicht erreicht werden.[55]Halder M, Petsophonsakul P, Akbulut AC, Pavlic A, Bohan F, Anderson E, Maresz K, Kramann R, Schurgers L (2019): Vitamin K: Double Bonds beyond Coagulation Insights into Differences between Vitamin K1 … Continue reading
Begleiterkrankungen und uc-MGP
Begleiterkrankungen wie Diabetes Typ 2, Bluthochdruck, chronische Nierenerkrankung, Fettleibigkeit usw. erhöhen den Schweregrad von COVID-19 und das Sterberisiko der Patienten. Diese Erkrankungen können durch einen Vitamin-K-Mangel gefördert werden. Erhöhte uc-MGP-Werte, die auf einen Vitamin-K-Mangel hindeuten, wurden bei Patienten mit Diabetes mellitus, Bluthochdruck, Herz-Kreislauf-Erkrankungen, chronische Nierenerkrankungen und Adipositas festgestellt – alles Erkrankungen, die in Verbindung mit Kalzifizierung der elastischen Fasern stehen.[56]Janssen R, Visser MPJ, Dofferhoff ASM, Vermeer C, Janssens W, Walk J (2020): Vitamin K metabolism as the potential missing link between lung damage and thromboembolism in Coronavirus disease 2019. … Continue reading
Der Zusammenhang zwischen uc-MGP und Begleiterkrankungen deutet darauf hin, dass ein Vitamin-K-Mangel diese Erkrankungen verschlimmern könnte bzw. das Risiko erhöht, daran zu erkranken. Ein weiterer Grund für erhöhte uc-MGP-Werte könnte jedoch auch ein verstärkter Verbrauch von Vitamin K in Zusammenhang mit den Erkrankungen sein.
Interessant ist in diesem Zusammenhang eine Extremform der schmerzhaften Bindegewebskalzifizierung, das Pseudoxanthoma elasticum. Bei der Immunelektronenmikroskopie zeigen sich hier nadelförmige Mineralausfällungen in den elastischen Fasern der Patienten.[57]Contri MB, Boraldi F, Taparelli F, De Paepe A, Ronchetti IP (1996): Matrix proteins with high affinity for calcium ions are associated with mineralization within the elastic fibers of pseudoxanthoma … Continue reading Diese werden insbesondere dadurch verursacht, dass in den elastischen Fasern nur geringe Mengen an reifem carboxyliertem MGP vorkommen, das die Verkalkung in weichem Bindegewebe verhindert.[58]Gheduzzi, D., Boraldi, F., Annovi, G. et al. (2007): Matrix Gla protein is involved in elastic fiber calcification in the dermis of pseudoxanthoma elasticum patients. Lab Invest 87, 998–1008. … Continue reading
Diese Mechanismen sind insgesamt sehr bedeutsam, denn jede Entzündung geht mit Kalzifizierungsprozessen einher, die oft auch schmerzhaft sind, wie z.B. Tendinosen (wie das „Painful Arc Syndrom“), Rheuma, Arthrose etc. (Es ist kein Wunder, dass Arthrose schmerzhaft ist, wenn Mikrokalzifizierungen den Gelenkknorpel zum Knirschen bringen). Neben Osteoprorose und Muskelschwäche (Sarkopenie) spielen auch bei diesen chronischen Erkrankungen nicht-carboxylierte MGP infolge eines Vitamin-K-Mangels eine wichtige Rolle.[59]Azuma K, Inoue S (2019): Multiple Modes of Vitamin K Actions in Aging-Related Musculoskeletal Disorders. Int J Mol Sci; 20(11):2844. Published 2019 Jun 11. doi:10.3390/ijms20112844[60]Khojah HM, Ahmed S, Abdel-Rahman MS, Alkhalil KM, Hamza AB (2017): Vitamin K homologs as potential biomarkers for disease activity in patients with rheumatoid arthritis. J Bone Miner Metab; … Continue reading [61]Viegas CSB, Costa RM, Santos L, et al. (2018): Gla-rich protein function as an anti-inflammatory agent in monocytes/macrophages: Implications for calcification-related chronic inflammatory diseases … Continue reading
Sowohl die chronisch obstruktive Lungenerkrankung (COPD), die mit einer respiratorischen Azidose einhergeht, als auch chronische Nierenerkrankungen, die oft eine metabolische Azidose auslösen, treiben eine deutlich verfrühte Gefäß-Kalzifizierung voran. Dem liegen die beschriebenen Effekte der Azidose und ein Vitamin K-Mangel bzw. ein erhöhter Vitamin-K-Bedarf zugrunde.[62]Piscaer, I, Wouters, EFM, Vermeer, C et al. (2017): Vitamin K deficiency: the linking pin between COPD and cardiovascular diseases?. Respir Res 18, 189. https://doi.org/10.1186/s12931-017-0673-z[63]Wasilewski GB, Vervloet MG, Schurgers LJ (2019): The Bone-Vasculature Axis: Calcium Supplementation and the Role of Vitamin K. Front Cardiovasc Med.; 6:6. doi: 10.3389/fcvm.2019.00006. PMID: … Continue reading
Hypertonie, Arteriosklerose und kalzifizierungshemmendes MGP
Bluthochdruck ist weltweit heute der wichtigste Risikofaktor für einen vorzeitigen Tod und eine Behinderung. Ein wesentlicher Grund: Hypertonie ist der Hauptauslöser von Arteriosklerose. Diese tritt am stärksten an Orten verstärkter Scherkräfte (Herzkranzgefäße, Gefäßgabelungen wie Carotis) auf, also dort, wo die elastischen Fasern der Gefäße am meisten unter Druck gesetzt und verletzt werden. Wie beschrieben, lagern verletzte elastische Fasern Calciumphosphat-Kristalle ein und kalzifizieren. Damit verhärten die Gefäße dauerhaft, die Blut- und Sauerstoffversorgung sinkt, der Blutdruck steigt kompensatorisch weiter an – der typische Teufelskreis, der die wichtigste Todesursache darstellt.
Bildlich gesprochen: In einem glatten Rohr bleiben Calciumphosphatablagerungen nicht hängen und sind reversibel, in einem porösen Rohr lagern sie sich permanent in der Rohrwand ab und verengen es immer mehr.
Zur Blutdrucksenkung spielen bekanntlich weniger Salz und viel Kalium eine zentrale Rolle, viele Medikamente wie ACE-Hemmer wirken auch über diesen Mechanismus. Darüber hinaus senkt eine gute Versorgung mit Vitamin K2 (180 µg pro Tag) in klinischen Studien deutlich die arterielle Gefäßsteifigkeit.[64]Knapen MH, Braam LA, Drummen NE, Bekers O, Hoeks AP, Vermeer C. Menaquinone-7 supplementation improves arterial stiffness in healthy postmenopausal women. A double-blind randomised clinical trial. … Continue reading Denn das durch Vitamin K aktivierte MGP hemmt die Kalzifizierung und senkt so die Gefäßsteifigkeit.
Daher könnte dem gezielten Ausgleich des Vitamin-K-Mangels und der ebenfalls oft bestehenden latenten Azidose bei all diesen Erkrankungen eine bisher nicht beachtete wichtige Rolle zukommen. Entscheidend dürfte hier die Form des eingesetzten Vitamin K und dessen Halbwertszeit sein.

Pufferkapazitäten mit Kalium-, Magnesium- und Calciumcitrat und basen-bildender Ernährung regenerieren, Vitamin D3 und K2 ergänzen
Die bei uns übliche Hauptquelle für Calcium sind Milchprodukte, welche auch reichlich Phosphat enthalten. Dies fördert bei der typischen säurebildenden Ernährung chronisch und bei der aktuten Azidose, die bei COVID-Atemnot auftritt, die Ausfällung von Calciumphosphat im Gefäß. Empfehlenswert ist basenbildendes Calcium aus pflanzlichen Quellen, da dieses auch die Übersäuerung ausgleicht. So enthalten Gemüse und Obst im Gegensatz zu Milchprodukten neben Calcium auch reichlich basenbildendes Magnesium- und Kaliumcitrat, die für den Säure-Basen-Haushalt und gezielten Elektrolytausgleich ebenfalls von großer Bedeutung sind. Tierische und industriell stark verarbeitete Lebensmittel wirken aufgrund ihrer Proteinzusammensetzung und ihres oft hohen Salzgehaltes dagegen säurebildend und sollten nur in Maßen verzehrt werden.
Für Personen ohne Niereninsuffizienz sind Kaliumcitrat, Magnesiumcitrat und Calciumcitrat besonders geeignet für den gezielten Ausgleich des Säure-Basen- und Mineralstoff-Haushalts.[65]Granchi D, Caudarella R, Ripamonti C, Spinnato P, Bazzocchi A, Massa A, Baldini N (2018): Potassium Citrate Supplementation Decreases the Biochemical Markers of Bone Loss in a Group of Osteopenic … Continue reading[66]Veronese N, Stubbs B, Solmi M, Noale M, Vaona A, Demurtas J, Maggi S (2017): Dietary magnesium intake and fracture risk: data from a large prospective study. Br J Nutr; 117(11): 1570-1576. Bei erhöhten Serumkaliumwerten bei Nierenkranken ist magensaftresistentes Natriumbikarbonat empfehlenswert.
Den Calciumverlust im Rahmen einer Azidose und COVID-19 gar nicht zu ersetzen, würde zu hypokalzämischen Störungen und zur Calcium-Mobilisierung aus den Knochen führen.[67]Carnauba RA, Baptistella AB, Paschoal V, Hübscher GH (2017): Diet-Induced Low-Grade Metabolic Acidosis and Clinical Outcomes: A Review. Nutrients; 9(6):538. Da zu viel Calcium, insbesondere als Calciumphosphat, aber auch die Blutgerinnung fördert und zu Verkalkungen führen kann, ist bei COVID-19 nur eine moderate Supplementierung (2 x 250 mg am Tag) und zusammen mit Kalium- und Magnesiumcitrat sowie Vitamin D3 und Vitamin K2 empfehlenswert. Kaliumcitrat reduziert dabei den Calciumverlust und damit den Calciumbedarf.[68]Jehle S, Zanetti A, Muser J, Hulter HN, Krapf R (2006): Partial neutralization of the acidogenic Western diet with potassium citrate increases bone mass in postmenopausal women with osteopenia. … Continue reading
Für einen gesunden Calciumhaushalt ist eine ausreichende Versorgung mit Vitamin D und Vitamin K essentiell. Da ein Mangel sehr häufig ist, ist es auf jeden Fall sinnvoll, die Blutwerte zu kontrollieren und einen Mangel auszugleichen – ganz besonders bei bestehender Infektion mit dem Coronavirus SARS-CoV-2.
Dosierung von Vitamin D und Vitamin K
Zur Prävention von Atemwegserkrankungen
Einer großen Meta-Analyse von 25 Doppel-Blind-Studien (höchster wissenschaftlicher Standard) mit über 11 000 Studienteilnehmern zufolge senkt Vitamin D bei Personen mit Vitamin-D-Mangel das Risiko für akute Atemwegserkrankungen um 70 %.[69]Martineau AR, Jolliffe DA, Hooper RL, Greenberg L, Aloia JF, Bergman P, Dubnov-Raz G, Esposito S, Ganmaa D, Ginde AA, Goodall EC, Grant CC, Griffiths C, Janssens W, Laaksi I, Manaseki-Holland S, … Continue reading Daher empfiehlt auch WHO eine Vitamin-D-Supplementierung gegen Atemwegsinfekte. Obwohl auch im Sommer Vitamin D-Mangel häufig ist, sollte spätestens ab Oktober bis Ende April eine Supplementierung erfolgen, da hier das Risiko für schwerwiegend verlaufende untere Atemwegsinfekte am höchsten ist. Diese waren schon immer eine führende Todesursache und fordern jährlich etwa 4 Millionen Menschen das Leben – schon vor COVID-19.
In Abhängigkeit vom Körpergewicht werden zur Prävention einer Virusinfektion der Atemwege für Senioren, Jugendliche und Erwachsene 40–60 I.E. Vitamin D pro kg Körpergewicht und Tag empfohlen. Für eine 70 kg schwere Person wären dies beispielsweise 2800–4200 I.E..[70]Gröber U, Holzhauer P, Kisters K (2020): Immunrelevante Mikronährstoffe bei viralen Atemwegsinfektionen. DZO; 52: 51-56. DOI: 10.1055/a-1162-2469 Im deutschen Winter wird Vitamin D meistens in einer Dosierung von 4000 I.E. (100 μg) pro Tag benötigt. Die US Geriatric Society empfiehlt diese Dosierung generell für Personen ab 70 Jahren.[71]American Geriatrics Society Workgroup on Vitamin D Supplementation for Older Adults (2014): Recommendations abstracted from the American Geriatrics Society Consensus Statement on vitamin D for … Continue reading
Der Vitamin-D-Bedarf kann bei Übergewicht und Entzündungsprozessen noch deutlich höher liegen. Ziel sind wirkungsvolle Blutwerte für das Immunsystem. Die renommierte Ärztegesellschaft für Altersmedizin und die Endokrine Gesellschaft bezeichnen den Vitamin-D-Blutwert von über 75 nmol/L (30 ng/mL) als unteren Zielwert (oberer Zielwert 125-150 nmol). Dies sei eine „physiologisch konservative Schätzung“ und argumentiert u.a., dass Menschen, die im Freien arbeiten, im Sommer regelmäßig doppelt so hohe Blutwerte haben.
Die Vitamin-K-Empfehlung des Food and Nutrition Board der USA für Erwachsene liegt bei etwa 100 μg Vitamin K pro Tag.[72]Booth SL (2012): Vitamin K: food composition and dietary intakes. Food Nutr Res; 56. DOI: 10.3402/fnr.v56i0.5505 Das empfohlene Verhältnis bei höheren Vitamin-D-Dosierungen beträgt damit in der Prävention etwa 1:1 (100 μg Vitamin D3 + 100 μg Vitamin K2). Bei besonderen Risikofaktoren (Osteoporose, Koronare Herzkrankheit, chronische Nierenerkrankungen, Entzündungs- und Kalzifizierungsprozesse jeder Art) sollte die Zufuhr von Vitamin K2 als MK-7 verdoppelt werden (Vitamin D im Verhältnis zu K2 1:2).
Besonders Nierenkranke haben oft eine latente metabolische Azidose und entwickeln frühzeitig ausgeprägte Kalzifizierungen in den Nieren und Gefäßen. Bei ihnen ist die Kombination von Vitamin D mit höherdosiertem K2 besonders wichtig. Auch ist hier bei der täglichen Dosierung bzw. beim Auffüllen eines Vitamin-D-Mangels größere Vorsicht geboten.
Was tun bei COVID-19 und bestehendem Vitamin-D-Mangel?
Die angesehene französische Académie nationale de Médecine empfiehlt seit Mai 2020 Senioren über 60 bei Vitamin-D-Mangel die Speicher mit einer Dosis von 50.000 bis 100.000 I.E. (1.250-2500 µg) aufzufüllen.[73]Académie nationale de Médecine (2020): Communiqué de l’Académie nationale de Médecine: Vitamine D et Covid-19. … Continue reading Dies kann helfen Komplikationen der Atemwege zu vermeiden und einem Zytokin-Sturm vorzubeugen. (Bei echtem Mangel ist die Dosis allerdings deutlich zu gering, um Speicher aufzufüllen.) In erfolgreichen klinischen Studien auf Intensivstationen wurden noch deutlich höhere Dosen eingesetzt. Dies sollte jedoch nicht im Selbstversuch erfolgen.
Liegt eine Infektion mit SARS-CoV-2 vor und es besteht ein Vitamin-D-Mangel, muss dieser zügig ausgeglichen werden. Bolusgaben sind dabei nicht ganz unproblematisch – und zwar nicht nur wegen der Bedenken von Janssen et al..[74]Janssen R, Visser MPJ, Dofferhoff ASM, Vermeer C, Janssens W, Walk J (2020): Vitamin K metabolism as the potential missing link between lung damage and thromboembolism in Coronavirus disease 2019. … Continue reading Daher ist die folgende Empfehlung ein sinnvoller Kompromiss zur schnellen Aufdosierung ohne hohe Bolusgaben:
Dosis-Empfehlung bei Vitamin-D-Mangel und COVID-19:
- 10 Tage lang 500 µg (20.000 I.E.) Vitamin D in Kombination mit 500 µg Vitamin K2, gefolgt von
- 1 Monat lang täglich 250 µg (10.000 I.E.) Vitamin D3 und 250 µg Vitamin K2.
- Anschließend Blutwerte bestimmen und Dosierung auf die präventive Dosis umstellen.
Weitere Informationen zum Calcium-Paradox erhalten Sie im Artikel:
Das Calcium-Paradox – warum Knochen morsch werden und Gefäße verkalken
Quellenverzeichnis[+]
| ↑1 | Puelles VG, Lütgehetmann M, Lindenmeyer MT, Sperhake JP et al. (2020): Multiorgan and Renal Tropism of SARS-CoV-2. N Engl J Med 383; 6. |
|---|---|
| ↑2 | Varga Z, Flammer AJ, Steiger P et al. (2020): Endothelial cell infection and endotheliitis in COVID-19. The Lancet 395: 10234, P1417-1418. |
| ↑3 | Huaxia (2020): Increase of two serum cytokines may predict severity of COVID-19. URL: http://www.xinhuanet.com/english/2020-02/18/c_138795808.htm (02.03.2020) |
| ↑4 | Horby P, Lim WS, Emberson J et al. (2020): Effect of Dexamethasone in Hospitalized Patients with COVID-19: Preliminary Report. MedRxiv Preprint. doi: https://doi.org/10.1101/2020.06.22.20137273. URL: https://www.medrxiv.org/content/10.1101/2020.06.22.20137273v1 (01.09.2020) |
| ↑5 | Benskin LL (2020): A Basic Review of the Preliminary Evidence That COVID-19 Risk and Severity Is Increased in Vitamin D Deficiency. Front Public Health; 8:513. Published 2020 Sep 10. doi:10.3389/fpubh.2020.00513 |
| ↑6 | Vormann J, Goedecke T (2006): Acid-Base Homeostasis: Latent Acidosis as a Cause of Chronic Diseases. Schweiz Zschr GanzheitsMedizin; 18(5). |
| ↑7, ↑9 | Sun JK, Zhang WH, Zou L, et al. (2020): Serum calcium as a biomarker of clinical severity and prognosis in patients with coronavirus disease 2019. Aging (Albany NY).; 12(12):11287-11295. doi:10.18632/aging.103526 |
| ↑8, ↑14 | Di Filippo L, Formenti AM, Rovere-Querini P, et al. (2020): Hypocalcemia is highly prevalent and predicts hospitalization in patients with COVID-19. Endocrine; 68(3):475-478. doi:10.1007/s12020-020-02383-5 |
| ↑10 | Zhou F, Yu T, Du R et a. (2020): Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. The Lancet 395(10229). DOI: 10.1016/S0140-6736(20)30566-3 |
| ↑11 | Tobin MJ, Laghi F, Jubran A (2020): Why COVID-19 Silent Hypoxemia Is Baffling to Physicians. Am J Respir Crit Care Med; 202(3):356-360. doi:10.1164/rccm.202006-2157CP |
| ↑12 | Lungenärzte im Web (2020): Wie am besten Covid-19 zu Hause überwachen? URL: https://www.lungenaerzte-im-netz.de/news-archiv/meldung/article/wie-am-besten-covid-19-zu-hause-ueberwachen/ (15.01.2021) |
| ↑13 | Brij SO, Peacock AJ (1998): Cellular responses to hypoxia in the pulmonary circulation. Thorax; 53:1075-1079. http://dx.doi.org/10.1136/thx.53.12.1075 |
| ↑15 | Kelly A, Levine MA (2011): Hypocalcemia in the Critically Ill patient. J Intensive Care Med.. 10.1177/0885066611411543. |
| ↑16, ↑17 | Pinheiro AR, Paramos-de-Carvalho D, Certal M, et al (2013): Bradykinin-induced Ca2+ signaling in human subcutaneous fibroblasts involves ATP release via hemichannels leading to P2Y12 receptors activation. Cell Commun Signal; 11:70. Published 2013 Sep 18. doi:10.1186/1478-811X-11-70 |
| ↑18 | ESC (European Society of Cardiology), 2020: ESC Guidance for the Diagnosis and Management of CV Disease during the COVID-19 Pandemic. URL: https://www.escardio.org/Education/COVID-19-and-Cardiology/ESC-COVID-19-Guidance (22.12.2020) |
| ↑19 | Yang C, Ma X, Wu J, et al. (2020): Low serum calcium and phosphorus and their clinical performance in detecting COVID-19 patients [published online ahead of print, 2020 Sep 14]. J Med Virol.; 10.1002/jmv.26515. doi:10.1002/jmv.26515 |
| ↑20 | Jacob LM (2013): Dr. Jacobs Weg des genussvollen Verzichts: Die effektivsten Maßnahmen zur Prävention und Therapie von Zivilisationskrankheiten. 3. Auflage. Nutricamedia, Heidesheim am Rhein. |
| ↑21 | Ackermann M, Verleden SE, Kuehnel M, et al. (2020): Pulmonary Vascular Endothelialitis, Thrombosis, and Angiogenesis in Covid-19. N Engl J Med; 383(2):120-128. doi: 10.1056/NEJMoa2015432. Epub 2020 May 21. PMID: 32437596; PMCID: PMC7412750. |
| ↑22 | Borczuk AC, Salvatore SP, Seshan SV, et al. (2020): COVID-19 pulmonary pathology: a multi-institutional autopsy cohort from Italy and New York City. Mod Pathol; 33(11):2156-2168. doi:10.1038/s41379-020-00661-1 |
| ↑23 | Jaber S, Paugam C, Futier E, et al. (2018): Sodium bicarbonate therapy for patients with severe metabolic acidaemia in the intensive care unit (BICAR-ICU): a multicentre, open-label, randomised controlled, phase 3 trial [published correction appears in Lancet. 2018 Dec 8;392(10163):2440]. Lancet. 2018;392(10141):31-40. doi:10.1016/S0140-6736(18)31080-8 |
| ↑24 | Yvan-Charvet L, Bonacina F, Guinamard RR, Norata GD. Immunometabolic function of cholesterol in cardiovascular disease and beyond. Cardiovasc Res. 2019;115(9):1393-1407. doi:10.1093/cvr/cvz127 |
| ↑25 | Li J, Wang X, Chen J, Zuo X, Zhang H, Deng A (2020): COVID-19 infection may cause ketosis and ketoacidosis. Diabetes Obes Metab; 22(10):1935-1941. doi:10.1111/dom.14057 |
| ↑26 | Jacob LM (2013): Dr. Jacobs Weg des genussvollen Verzichts: Die effektivsten Maßnahmen zur Prävention und Therapie von Zivilisationskrankheiten. 3. Auflage. Nutricamedia, Heidesheim am Rhein. |
| ↑27 | Chen D, Li X, Song Q, et al. (2020): Assessment of Hypokalemia and Clinical Characteristics in Patients With Coronavirus Disease 2019 in Wenzhou, China. JAMA Netw Open; 3(6):e2011122. Published 2020 Jun 1. doi:10.1001/jamanetworkopen.2020.11122 |
| ↑28, ↑30 | Micke O, Vormann J, Kisters K (2020): Magnesium deficiency and COVID-19 – What are the links?Some remarks from the German Society for Magnesium Research e.V. Trace Elements and Electrolytes, Vol. 37 – No. 3/2020 (103-107). URL: https://www.magnesium-ges.de/pdfs/Micke_et_al._2020.pdf (22.12.2020) |
| ↑29 | Prutkin JM (2020): Coronavirus disease 2019 (COVID-19): Arrhythmias and conduction system disease. www.uptodate.com/contents/coronavirus-disease-2019-covid-19-arrhythmias-and-conduction-system-disease |
| ↑31, ↑35, ↑40, ↑41, ↑50, ↑51, ↑52, ↑56, ↑74 | Janssen R, Visser MPJ, Dofferhoff ASM, Vermeer C, Janssens W, Walk J (2020): Vitamin K metabolism as the potential missing link between lung damage and thromboembolism in Coronavirus disease 2019. British Journal of Nutrition, 1-8. doi:10.1017/S0007114520003979 |
| ↑32, ↑33, ↑38 | Dofferhoff ASM, Piscaer I, Schurgers LJ et al. (2020): Reduced Vitamin K Status as a Potentially Modifiable Prognostic Risk Factor in COVID-19. Clinical Infectious Diseases, ciaa1258, https://doi.org/10.1093/cid/ciaa1258 |
| ↑34 | Linneberg A, Kampmann FB, Israelsen SB, Andersen LR, Jørgensen HL, Sandholt H, Jørgensen NR, Thysen SM, Benfield T (2020): Low vitamin K status predicts mortality in a cohort of 138 hospitalized patients with COVID-19. medRxiv 2020.12.21.20248613; doi: https://doi.org/10.1101/2020.12.21.20248613 |
| ↑36 | Anastasi E, Ialongo C, Labriola R, Ferraguti G, Lucarelli M, Angeloni A (2020): Vitamin K deficiency and covid-19, Scandinavian Journal of Clinical and Laboratory Investigation, DOI:10.1080/00365513.2020.1805122 |
| ↑37 | Pivin E, Ponte B, Pruijm M et al. (2015): Inactive Matrix Gla-Protein Is Associated With Arterial Stiffness in an Adult Population-Based Study. Hypertension; 66(1):85-92. doi: 10.1161/HYPERTENSIONAHA.115.05177. Epub 2015 May 18. PMID: 25987667. |
| ↑39 | Schurgers LJ, Barreto DV, Barreto FC, Liabeuf S, Renard C, Magdeleyns EJ, Vermeer C, Choukroun G, Massy ZA (2010): The circulating inactive form of matrix gla protein is a surrogate marker for vascular calcification in chronic kidney disease: a preliminary report. Clin J Am Soc Nephrol; 5(4): 568-575 |
| ↑42 | Suleiman L, Negrier C, Boukerche H (2013): Protein S: a multifunctional anticoagulant vitamin K-dependent protein at the crossroads of coagulation, inflammation, angiogenesis, and cancer. Crit Rev Oncol Hematol; 88(3): 637–654. |
| ↑43 | Biesalski HK, Bischoff SC, Pirlich M, Weimann A (Hrsg.) (2017): Ernährungsmedizin. 5., vollständig überarbeitete und erweiterte Auflage. Stuttgart: Thieme. doi:10.1055/b-004-132260 |
| ↑44 | Cantorna MT, Snyder L, Arora J (2019): Vitamin A and vitamin D regulate the microbial complexity, barrier function, and the mucosal immune responses to ensure intestinal homeostasis. Crit Rev Biochem Mol Biol;54(2):184-192. DOI: 10.1080/10409238.2019.1611734 |
| ↑45 | Gröber U, Holzhauer P, Kisters K (2020): Immunrelevante Mikronährstoffe bei viralen Atemwegsinfektionen. DZO; 52: 51-56. DOI: 10.1055/a-1162-2469 |
| ↑46 | Mileva M, Galabov AS (2018): Vitamin E and Influenza Virus Infection, Vitamin E in Health and Disease, Morales-Gonzalez JA, IntechOpen. DOI: 10.5772/intechopen.80954 |
| ↑47 | Glynn RJ, Ridker PM, Goldhaber SZ, Zee RY, Buring JE (2007): Effects of random allocation to vitamin E supplementation on the occurrence of venous thromboembolism: report from the Women’s Health Study. Circulation; 116(13):1497-503. doi: 10.1161/CIRCULATIONAHA.107.716407. |
| ↑48 | Ikeda S, Hanzawa F, Takahashi S, Suzuki N, Sano K, Oda H, Uchida T. Tissue Distribution of Menaquinone-7 and the Effect of α-Tocopherol Intake on Menaquinone-7 Concentration in Rats. J Nutr Sci Vitaminol (Tokyo). 2018;64(6):391-398. doi: 10.3177/jnsv.64.391. |
| ↑49 | Singh I, Turner AH, Sinclair AJ, Li D, Hawley JA (2007): Effects of gamma-tocopherol supplementation on thrombotic risk factors. Asia Pac J Clin Nutr.; 16(3):422-428. |
| ↑53, ↑54 | Schurgers LJ, Teunissen KJ, Hamulyák K, Knapen MH, Vik H, Vermeer C (2007): Vitamin K-containing dietary supplements: comparison of synthetic vitamin K1 and natto-derived menaquinone-7. Blood; 109(8): 3279-3283 |
| ↑55 | Halder M, Petsophonsakul P, Akbulut AC, Pavlic A, Bohan F, Anderson E, Maresz K, Kramann R, Schurgers L (2019): Vitamin K: Double Bonds beyond Coagulation Insights into Differences between Vitamin K1 and K2 in Health and Disease. Int J Mol Sci; 20(4):896. doi: 10.3390/ijms20040896. |
| ↑57 | Contri MB, Boraldi F, Taparelli F, De Paepe A, Ronchetti IP (1996): Matrix proteins with high affinity for calcium ions are associated with mineralization within the elastic fibers of pseudoxanthoma elasticum dermis. Am J Pathol.; 148(2):569-577. |
| ↑58 | Gheduzzi, D., Boraldi, F., Annovi, G. et al. (2007): Matrix Gla protein is involved in elastic fiber calcification in the dermis of pseudoxanthoma elasticum patients. Lab Invest 87, 998–1008. https://doi.org/10.1038/labinvest.3700667 |
| ↑59 | Azuma K, Inoue S (2019): Multiple Modes of Vitamin K Actions in Aging-Related Musculoskeletal Disorders. Int J Mol Sci; 20(11):2844. Published 2019 Jun 11. doi:10.3390/ijms20112844 |
| ↑60 | Khojah HM, Ahmed S, Abdel-Rahman MS, Alkhalil KM, Hamza AB (2017): Vitamin K homologs as potential biomarkers for disease activity in patients with rheumatoid arthritis. J Bone Miner Metab; 35(5):529-535. doi:10.1007/s00774-016-0785-4 |
| ↑61 | Viegas CSB, Costa RM, Santos L, et al. (2018): Gla-rich protein function as an anti-inflammatory agent in monocytes/macrophages: Implications for calcification-related chronic inflammatory diseases [published correction appears in PLoS One; 13(2):e0192875]. PLoS One. 2017;12(5):e0177829. Published 2017 May 18. doi:10.1371/journal.pone.0177829 |
| ↑62 | Piscaer, I, Wouters, EFM, Vermeer, C et al. (2017): Vitamin K deficiency: the linking pin between COPD and cardiovascular diseases?. Respir Res 18, 189. https://doi.org/10.1186/s12931-017-0673-z |
| ↑63 | Wasilewski GB, Vervloet MG, Schurgers LJ (2019): The Bone-Vasculature Axis: Calcium Supplementation and the Role of Vitamin K. Front Cardiovasc Med.; 6:6. doi: 10.3389/fcvm.2019.00006. PMID: 30805347; PMCID: PMC6370658. |
| ↑64 | Knapen MH, Braam LA, Drummen NE, Bekers O, Hoeks AP, Vermeer C. Menaquinone-7 supplementation improves arterial stiffness in healthy postmenopausal women. A double-blind randomised clinical trial. Thromb Haemost. 2015 May;113(5):1135-44. doi: 10.1160/TH14-08-0675 |
| ↑65 | Granchi D, Caudarella R, Ripamonti C, Spinnato P, Bazzocchi A, Massa A, Baldini N (2018): Potassium Citrate Supplementation Decreases the Biochemical Markers of Bone Loss in a Group of Osteopenic Women: The Results of a Randomized, Double-Blind, Placebo-Controlled Pilot Study. Nutrients; 10(9):1293. doi: 10.3390/nu10091293. PMID: 30213095; PMCID: PMC6164684. |
| ↑66 | Veronese N, Stubbs B, Solmi M, Noale M, Vaona A, Demurtas J, Maggi S (2017): Dietary magnesium intake and fracture risk: data from a large prospective study. Br J Nutr; 117(11): 1570-1576. |
| ↑67 | Carnauba RA, Baptistella AB, Paschoal V, Hübscher GH (2017): Diet-Induced Low-Grade Metabolic Acidosis and Clinical Outcomes: A Review. Nutrients; 9(6):538. |
| ↑68 | Jehle S, Zanetti A, Muser J, Hulter HN, Krapf R (2006): Partial neutralization of the acidogenic Western diet with potassium citrate increases bone mass in postmenopausal women with osteopenia. Journal of the American Society of Nephrology : JASN; 17(11): 3213-3222 |
| ↑69 | Martineau AR, Jolliffe DA, Hooper RL, Greenberg L, Aloia JF, Bergman P, Dubnov-Raz G, Esposito S, Ganmaa D, Ginde AA, Goodall EC, Grant CC, Griffiths C, Janssens W, Laaksi I, Manaseki-Holland S, Mauger D, Murdoch DR, Neale R, Rees JR, Simpson S Jr, Stelmach I, Kumar GT, Urashima M, Camargo CA Jr (2017): Vitamin D supplementation to prevent acute respiratory tract infections: systematic review and meta-analysis of individual participant data. BMJ; 356: i6583. |
| ↑70 | Gröber U, Holzhauer P, Kisters K (2020): Immunrelevante Mikronährstoffe bei viralen Atemwegsinfektionen. DZO; 52: 51-56. DOI: 10.1055/a-1162-2469 |
| ↑71 | American Geriatrics Society Workgroup on Vitamin D Supplementation for Older Adults (2014): Recommendations abstracted from the American Geriatrics Society Consensus Statement on vitamin D for Prevention of Falls and Their Consequences. J Am Geriatr Soc; 62(1): 147-152. DOI: 10.1111/jgs.12631 |
| ↑72 | Booth SL (2012): Vitamin K: food composition and dietary intakes. Food Nutr Res; 56. DOI: 10.3402/fnr.v56i0.5505 |
| ↑73 | Académie nationale de Médecine (2020): Communiqué de l’Académie nationale de Médecine: Vitamine D et Covid-19. URL: http://www.academie-medecine.fr/communique-de-lacademie-nationale-de-medecine-vitamine-d-et-covid-19/ (21.10.2020) |
